
| 臨床研究の実施に関する手続き |
|---|
|
(1)特定臨床研究の実施に係る措置
② 実施計画による実施の適否等について、認定臨床研究審査委員会の意見を聴いたうえで厚生労働大臣に提出することを義務付け |
| 製薬企業等の講ずべき措置 |
|---|
|
① 製薬企業等に対して、当該製薬企業等の医薬品等の臨床研究に対して資金を提供する際の契約の締結を義務付け |
製薬企業からの提案などの働きかけをきっかけに実施されることも少なくない臨床研究ですが、臨床研究の実施者である研究責任医師を主体としています。それは、この臨床研究が診療の上に成り立っており、何よりも優先されるべきは目の前の患者さんの治療であること、そして得られた貴重なデータはその先にいる患者さんの治療に活かしていくことなど研究の実施はもちろん、得られた研究データや結果にも医療行為と同様に高い倫理観と信頼が求められるためです。
なお、研究責任医師の要件として、厚労省医政局研究開発振興課長通知に以下のように定められています。
| 研究責任医師は、以下の要件に該当する場合、原則として研究責任医師から外れる |
|---|
|
なお、研究責任医師の不適格要件に該当する場合、データ管理やモニタリング、統計・解析業務に従事することもできません。
研究責任医師は、作成が義務付けられている研究計画書を利益相反管理基準、利益相反管理計画などとともに、厚生労働省が認定する認定臨床計画審査委員会に提出する必要があります。認定臨床研究審査委員会(CRB:Certified Review Board)は、医学・医療の専門家や法律の専門家をはじめ、様々な立場の方を交えた5人以上で構成することとされており、平成30年4月30日現在、全国に52の審査委員会が認定されています。なお、審査会の認定の有効期限は、当該認定の日から起算して3年です。
*認定臨床研究審査委員会一覧(H30.4.30現在)
| 北海道大学 | 昭和大学 | 藤田保健衛生大学 | 大阪大学 |
| 東北大学 | 順天堂 | 名古屋大学 | 岡山大学 |
| 福島県立医科大学 | 日本大学 | 金沢大学 | 山口大学 |
| 日本医科大学 | 信州大学 | 三重大学 | 徳島大学 |
| 北里研究所 | 千葉大学 | 金沢医科大学 | 愛媛大学 |
| 自治医科大学 | 東邦大学 | 浜松医科大学 | 長崎大学 |
| 量子科学技術研究開発機構 | 慶応義塾 | 国立病院機構(愛知) | 琉球大学 |
| 沖縄徳洲会 | 国立病院機構(東京1) | 京都府立医科大学 | 国立病院機構(福岡) |
| 国立精神・神経医療研究センター | 国立病院機構(東京2) | 京都大学 | 治験ネットワーク福岡 |
| 横浜市立大学 | 東京医科歯科大学 | 大阪市立大学 | 九州大学 |
| 国立がん研究センター(東京) | 国立国際医療研究センター | 和歌山県立医科大学 | 静岡がんセンター |
| 国立がん研究センター(千葉) | 名古屋市立大学 | 兵庫医科大学 | 埼玉医科大学 |
| 国家公務員共済組合連合会 | 愛知県がんセンター | 国立病院機構(大阪) | 熊本大学 |
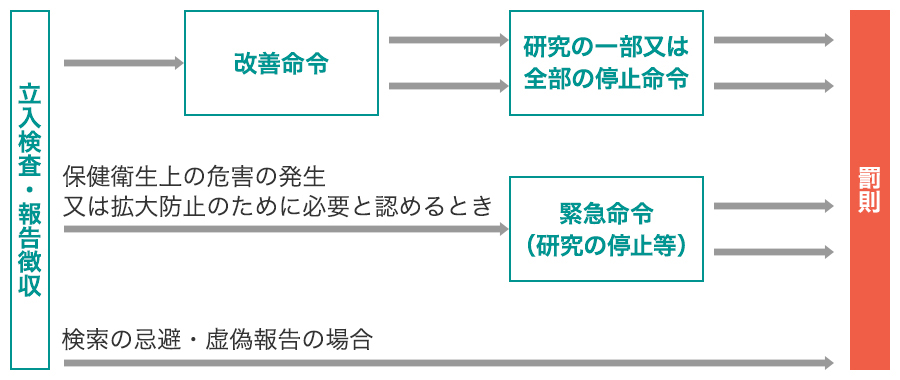
審査委員会は、提出された研究計画書が実施基準に適合しているかチェックし、研究実施の適否などを研究責任医師にフィードバックします。それを受けて研究責任医師は指摘事項を反映させた実施計画を厚生労働大臣に提出します。なお、正当な理由なく実施計画書を提出せず、またはこれに記載すべき事項を記載せずもしくは虚偽の記載をした実施計画書を提出し特定臨床研究を実施した場合、50万円以下の罰金に処せられます。
これまでの厚生労働省からの倫理指針に基づいた行政指導には強制力がありませんでした。が、法律に基づく指導・改善命令が可能となり、保健衛生上の危害発生・拡大防止のために必要な場合には停止命令も可能となりました。
臨床研究法では、利益相反の観点から製薬企業に対し資金提供に関する契約締結と情報の公表を義務付けています。
| 公表の対象となるもの |
|---|
※自社製品の臨床研究終了後2年以内の資金提供も含む |
上記以外の講演に伴う交通費や会場費、研究に対する労務提供や物品提供などは公表の対象外となっています。公表の方法は、インターネットのみ有効とし、それ以外の公表は認められません。また、申請しないと閲覧できない方法や印刷できないような設定も禁止されています。
なお、経過措置として平成30年10月以後に開始する事業年度分から公表の対象となっており、公開の時期は毎事業年度終了後1年以内に行い、公表後5年間公開すると定められています。
厚生労働省:臨床研究法について【詳しくはこちら】